Notre recherche
Le matériel génétique est le substrat de transactions telles que la transcription et la réplication, qui engendrent le risque de créer des lésions. De plus, l’ADN est exposé à des sources de dommages externes et internes. Dans tous ces cas, la cellule met en œuvre des mécanismes de surveillance et de réparation pour préserver l’intégrité du génome. Tous ces événements se déroulent dans le noyau de la cellule et, par conséquent, énormément d’efforts ont été consacrées à la compréhension de ces mécanismes nucléaires.
Pourtant, le noyau est enchâssé dans le cytoplasme, et des recherches récentes commencent à mettre en lumière l’impact que des processus jusqu’ici considérés comme exclusivement cytoplasmiques peuvent avoir sur l’organisation, la maintenance et la dynamique du génome. L’objectif de notre équipe est d’élargir nos connaissances sur la façon dont les configurations nutritionnelles, les signaux environnementaux et les altérations métaboliques affectent ou même contrôlent le maintien de l’intégrité du génome.
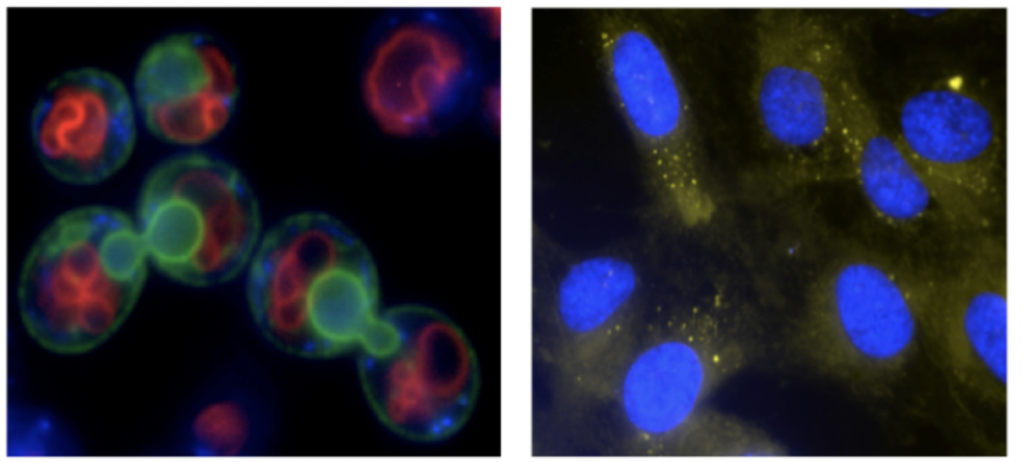
En particulier, nous nous concentrons sur la contribution des lipides. Les lipides constituent une famille vaste et versatile de biomolécules connues pour leurs rôles essentiels en tant que constituants des membranes, sources d’énergie et leurs capacités de signalisation. Pourtant, la question de savoir si ces fonctions (ou d’autres) sont importantes pour l’homéostasie nucléaire, en général, et pour la surveillance et le maintien de la stabilité du génome, en particulier, reste presque inexplorée. Nous utilisons la levure Sacharomyces cerevisiae et des cellules humaines en culture comme systèmes modèles. Nous utilisons une combinaison de génétique, de biologie moléculaire, de biochimie et de microscopie pour évaluer ces questions
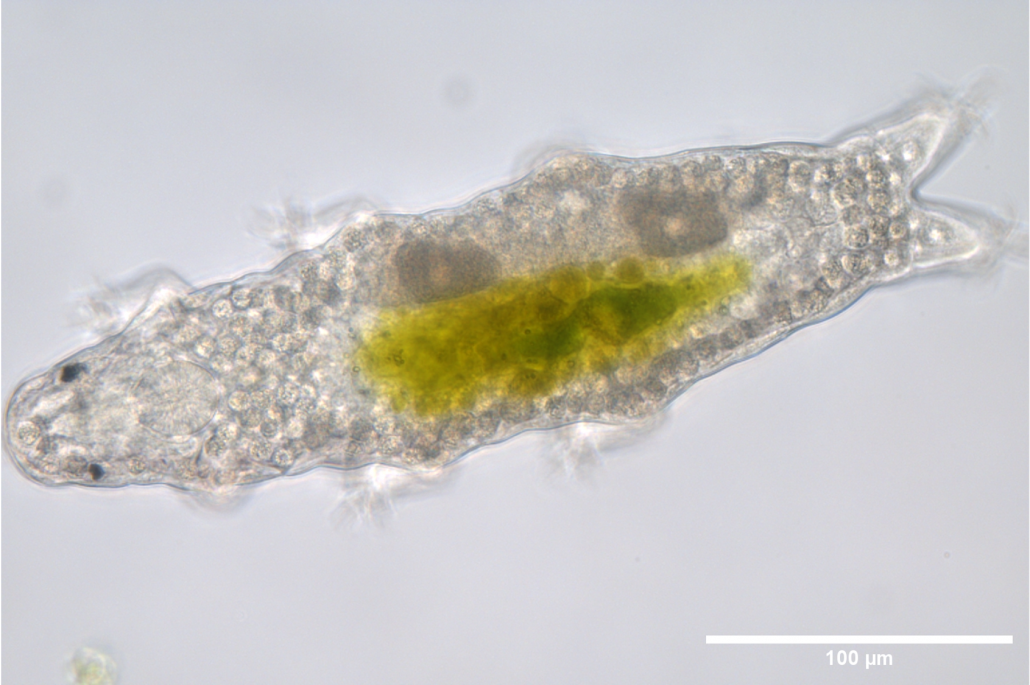
De plus, afin d’approfondir nos connaissances sur la détection des dommages à l’ADN et la régulation de ce processus, nous avons récemment intégré à notre laboratoire en tant que modèle expérimental le tardigrade Hypsibius exemplaris. Les tardigrades sont des organismes extrêmophiles connus pour supporter des conditions vraiment dures telles que des températures extrêmes, la déshydratation et les radiations ionisantes (IR). En particulier, H. exemplaris est fortement résistant aux IR à l’état adulte (et hydraté), présentant ainsi une remarquable résistance aux dommages de l’ADN par rapport à la plupart des organismes. Nous utilisons H. exemplaris pour améliorer notre compréhension des bases cellulaires et moléculaires de cette extraordinaire tolérance aux dommages de l’ADN. H. exemplaris est un excellent modèle, car il possède un génome séquencé, peut être étudié au niveau moléculaire grâce à des protocoles bien établis, a un cycle de vie court, et est transparent, ce qui nous aide dans les approches basées sur la microscopie.
En savoir plus
L’équipe en Mars 2022

L’équipe en Mars 2021

L’équipe en Mars 2020

L’équipe en Mars 2019

Financements
Publications
2024
- Storage cell proliferation during somatic growth establishes that tardigrades are not eutelic organisms. Quiroga-Artigas G, Moriel-Carretero M. Biol Open. 2024 Feb 15;13(2):bio060299.. Pubmed
2023
- An Expansion of the Endoplasmic Reticulum that Halts Autophagy is Permissive to Genome Instability. Lara-Barba E, Torán-Vilarrubias A, Moriel-Carretero M. Contact (Thousand Oaks). 2023 Feb 22;6:25152564231157706. Pubmed
- Nuclear envelope-remodeling events as models to assess the potential role of membranes on genome stability. Bâcle J, Groizard L, Kumanski S, Moriel-Carretero M. FEBS Lett. 2023 Jun 20. Pubmed
- A sterol-PI(4)P exchanger modulates the Tel1/ATM axis of the DNA damage response. Ovejero S, Kumanski S, Soulet C, Azarli J, Pardo B, Santt O, Constantinou A, Pasero P, Moriel-Carretero M. EMBO J. 2023 Jun 12:e112684. Pubmed
- Auxin alone provokes retention of ASH1 mRNA in Saccharomyces cerevisiae mother cells. Domeni Zali G, Moriel-Carretero M. MicroPubl Biol. 2023 Feb 22;2023:10.17912/micropub.biology.000752.Pubmed
2022
- Nuclear ingression of cytoplasmic bodies accompanies a boost in autophagy. Garcia M, Kumanski S, Elías-Villalobos A, Cazevieille C, Soulet C, Moriel-Carretero M. Life Sci Alliance. 2022 May 13;5(9):e202101160. Pubmed
- Coordination between phospholipid pools and DNA damage sensing. Ovejero S, Soulet C, Kumanski S, Moriel-Carretero M. Biol Cell. 2022 May 7. Pubmed
- Nuclear Lipid Droplet Birth during Replicative Stress. Kumanski S, Forey R, Cazevieille C, Moriel-Carretero M. Cells. 2022 11, 1390. Pubmed
2021
- The Many Faces of Lipids in Genome Stability (and How to Unmask Them). Moriel-Carretero M. Int J Mol Sci. 2021 Nov 29;22(23):12930. Pubmed
- Lack of evidence for condensin or cohesin sequestration on lipid droplets with packing defects. Mura A, Moriel-Carretero M. MicroPubl Biol. 2021 Nov 4;2021 Pubmed
- Microscopy analysis of the smallest subunit of the RPA complex, Rfa3p, prompts consideration of how RPA subunits gather at single-stranded DNA sites. Ramonatxo A, Moriel-Carretero M. MicroPubl Biol. 2021 Oct 27:2021:10.17912/micropub.biology.000493. Pubmed
- Oxidative agents elicit endoplasmic reticulum morphological changes suggestive of alterations in lipid metabolism. Torán-Vilarrubias A, Moriel-Carretero M. MicroPubl Biol. 2021 Sep 20 (eCollection 2021) Pubmed
- Daughter cell-targeted mRNAs can achieve segregation without the universal Endoplasmic Reticulum docker She2p. Samardak K, Moriel-Carretero M. MicroPubl Biol. 2021 Sep 13 (eCollection 2021) Pubmed
- The Alkylating Agent Methyl Methanesulfonate Triggers Lipid Alterations at the Inner Nuclear Membrane That Are Independent from Its DNA-Damaging Ability. Ovejero S, Soulet C, Moriel-Carretero M. Int J Mol Sci. 22(14):7461. Pubmed
- Lipid Droplets Are a Physiological Nucleoporin Reservoir. Kumanski S, Viart BT, Kossida S, Moriel-Carretero M. Cells. 10(2):472. Pubmed
2020
- Homologous Recombination and Mus81 Promote Replication Completion in Response to Replication Fork Blockage. Benjamin Pardo, María Moriel-Carretero, Thibaud Vicat, Andrés Aguilera , Philippe Pasero. EMBO Rep. 17;e49367 Pubmed
- The Hypothetical Role of Phosphatidic Acid in Subverting ER Membranes During SARS-CoV Infection. María Moriel-Carretero. Traffic . 2020 May 18. doi: 10.1111/tra.12738 Pubmed
2019
Contrôle cytoplasmique de la stabilité du génome
María MORIEL-CARRETERO
Cheffe d’équipe (Chercheuse CRCN)
Membres de l’équipe
(IR-Recherche) +33 (0)4 34 35 96 83 |
|
(Doctorant) +33 (0)4 34 35 95 64 |
|
(Chercheur) +33 (0)4 34 35 95 64 |
|
(Chercheur) +33 (0)4 34 35 96 83 |
|
(Doctorant) +33 (0)4 34 35 96 83 |
|
(IE-Recherche) +33 (0)4 34 35 96 83 |
team
team
Contactez notre équipe
Remplacez le nom et l’adresse ci-dessus par celui du membre à contacter
prenom.nom@crbm.cnrs.fr