
Notre recherche
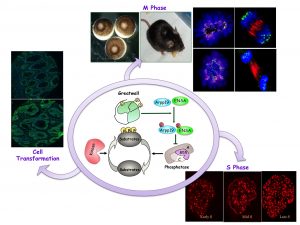
Notre équipe s’intéresse depuis plusieurs années aux mécanismes qui régulent l’entrée, la progression et la sortie de la mitose. Cette phase cruciale de la vie de la cellule a pour objectif majeur de séparer de façon égale les chromosomes de la cellule mère au sein des deux cellules filles. Pour cela, de nombreux régulateurs mitotiques s’activent, changent de localisation, se modifient, se dégradent… Ceci est sous le contrôle de nombreuses voies de transduction qui se mettent en place afin de réguler les différentes étapes de la mitose. C’est dans ce cadre que notre équipe s’attache à comprendre les mécanismes moléculaires qui interviennent lorsque la cellule entre en division. De façon plus précise, nous nous intéressons à l’activation et l’inactivation coordonnées de nombreuses protéines kinase et phosphatase et de leurs substrats qui ensemble s’assurent du bon déroulement des deux divisions cellulaires que sont la méiose et la mitose. Plus récemment, nous avons pu montrer que ces régulateurs mitotiques pouvaient aussi contrôler d’autres phases ou propriétés de la vie de la cellule comme la réplication de l’ADN ou la transformation cellulaire.
En savoir plus
La voie Greatwall / Arpp19-ENSA / PP2A-B55 et le cycle cellulaire.
Notre laboratoire s’intéresse au rôle des kinases et des phosphatases dans la régulation de l’entrée et de la progression mitotiques. La mitose nécessite une phosphorylation massive de protéines favorisée par la kinase Cdk1-CyclineB. Historiquement, il a été admis que la phosphorylation des protéines lors de la mitose était sous le contrôle de Cdk1-Cycline B et que l’activité phosphatase responsable de la déphosphorylation de ces protéines était constante. Nous avons démontré, pour la première fois, que l’activité de la phosphatase est également modulée afin de favoriser une mitose correcte. Nos études sur les extraits d’œufs de Xenope ont identifié une nouvelle voie de contrôle de la phosphatase mitotique incluant la kinase Greatwall (Gwl) et ses substrats Arpp19 et ENSA. Nous avons montré que lors de l’entrée mitotique, Gwl est activée et phosphoryle Arpp19 et ENSA favorisant ainsi leur liaison à PP2A-B55 et son inhibition. Il en résulte une phosphorylation stable des protéines et une entrée mitotique. Nos données ont démontré que cette voie est conservée dans les cellules humaines en culture. Actuellement, nous étudions le rôle de Gwl/Arpp19-ENSA/PP2A-B55 dans l’homéostasie des tissus en utilisant des souris knock-out inductibles. Outre le rôle dans la division mitotique, nous avons démontré que cette voie de signalisation est également impliquée dans d’autres phases du cycle cellulaire. Nos données récentes montrent que cette voie de signalisation est impliquée dans le contrôle de la phase S en contrôlant la dynamique de réplication de l’ADN. Enfin, nous avons identifié Gwl comme un oncogène puissant favorisant la transformation des cellules en contrôlant l’activité d’Akt. Par la suite, nous tenterons d’identifier les mécanismes impliqués dans les phénotypes observés chez les souris adultes knock out et la voie responsable de la régulation Akt dépendante de Gwl. De plus, nous étudierons la voie par laquelle Gwl/Ensa/PP2A-B55 contrôle la phase S. Enfin, nous nous concentrerons également sur l’identification de nouveaux substrats de Gwl.
Financements
Equipe labelisée Ligue Nationale Contre le Cancer
ANR KiARP (Thierry Lorca, Lionel Pintard)
ANR REPLIGREAT (Anna Castro, Lionel Pintard & Philippe Pasero)
ANR JCJC MTDISco (Benjamin Lacroix)
Université de Montpellier (Anna Castro)
FRM (Anna Castro)
ANR MITODISSECT (Pintard l et Lorca T)
Publications
2025
- The MAST kinase KIN-4 carries out mitotic entry functions of Greatwall in C. elegans. Roumbo L, Ossareh-Nazari B, Vigneron S, Stefani I, Van Hove L, Legros V, Chevreux G, Lacroix B, Castro A, Joly N, Lorca T, Pintard L. EMBO J. 2025 Feb 17. Epub ahead of print. Pubmed
2024
- Measuring Mitotic Spindle and Microtubule Dynamics in Marine Embryos and Non-model Organisms. Chenevert J, Robert MLV, Sallé J, Cacchia S, Lorca T, Castro A, McDougall A, Minc N, Castagnetti S, Dumont J, Lacroix B. Methods Mol Biol. 2024;2740:187-210. Pubmed
- Cell Cycle Control : Methods and Protocols. Castro A & Lacroix B. Editors Part of the book series: Methods in Molecular Biology (Springer Protocols, Humana Press. 2024. Link
- Increases in cyclin A/Cdk activity and in PP2A-B55 inhibition by FAM122A are key mitosis-inducing events. Lacroix B, Vigneron S, Labbé JC, Pintard L, Lionne C, Labesse G, Castro A, Lorca T. EMBO J. 2024 Feb 20. Pubmed
2023
- Synergistic stabilization of microtubules by BUB-1, HCP-1 and CLS-2 controls microtubule pausing and meiotic spindle assembly. Macaisne N, Bellutti L, Laband K, Edwards F, Pitayu-Nugroho L, Gervais A, Ganeswaran T, Geoffroy H, Maton G, Canman JC, Lacroix B, Dumont J. Elife. 2023 Feb 17;12:e82579. Pubmed
2022
- Structural organization and dynamics of FCHo2 docking on membranes. El Alaoui F, Casuso I, Sanchez-Fuentes D, Arpin-Andre C, Rathar R, Baecker V, Castro A, Lorca T, Viaud J, Vassilopoulos S, Carretero-Genevrier A, Picas L. Elife. 2022 Jan 19;11:e73156. Pubmed
- PP2A-B55: substrates and regulators in the control of cellular functions. Amin P, Awal S, Vigneron S, Roque S, Mechali F, Labbé JC, Lorca T, Castro A. Oncogene. 2022 Jan;41(1):1-14. Pubmed
2021
- The study of the determinants controlling Arpp19 phosphatase-inhibitory activity reveals an Arpp19/PP2A-B55 feedback loop. Labbé JC, Vigneron S, Méchali F, Robert P, Roque S, Genoud C, Goguet-Rubio P, Barthe P, Labesse G, Cohen-Gonsaud M, Castro A, Lorca T. Nat Commun. 12(1):3565. Pubmed
- Bora phosphorylation substitutes in trans for T-loop phosphorylation in Aurora A to promote mitotic entry. Tavernier N, Thomas Y, Vigneron S, Maisonneuve P, Orlicky S, Mader P, Regmi SG, Van Hove L, Levinson NM, Gasmi-Seabrook G, Joly N, Poteau M, Velez-Aguilera G, Gavet O, Castro A, Dasso M, Lorca T, Sicheri F, Pintard L. Nat Commun. 12(1):1899 Pubmed
2020
- PP2A-B55 Holoenzyme Regulation and Cancer. Perrine Goguet-Rubio, Priya Amin, Sushil Awal, Suzanne Vigneron, Sophie Charrasse, Francisca Mechali, Jean Claude Labbé, Thierry Lorca, Anna Castro. Biomolecules . 10(11):1586. Pubmed
2019
- Arpp19 and ENSA, two PP2A-B55 phosphatase inhibitors that differentially control the cell cycle. Hached K, Goguet-Rubio P, Charrasse S, Lorca T, Castro A. Med Sci (Paris). 35(6-7):504-506 Pubmed
- Nuclear import of Xenopus egg extract components into cultured cells for reprogramming purposes: a case study on goldfish fin cells. Chênais N, Lorca T, Morin N, Guillet B, Rime H, Le Bail PY, Labbé C. Sci Rep. 9(1):2861. Pubmed
- ENSA and ARPP19 differentially control cell cycle progression and development. Hached K, Goguet P, Charrasse S, Vigneron S, Sacristan MP, Lorca T, Castro A. J Cell Biol. pii: jcb.201708105. Pubmed
2018
- Greatwall kinase at a glance. Castro A, Lorca T. J Cell Sci. 131(20). Pubmed
- Cyclin A-cdk1-Dependent Phosphorylation of Bora Is the Triggering Factor Promoting Mitotic Entry. Vigneron S, Sundermann L, Labbé JC, Pintard L, Radulescu O, Castro A, Lorca T. Dev Cell. 45(5):637-650. Pubmed
2017
- Ensa controls S-phase length by modulating Treslin levels. Charrasse S, Gharbi-Ayachi A, Burgess A, Vera J, Hached K, Raynaud P, Schwob E, Lorca T, Castro A. Nat Commun. 8(1):206 Pubmed
- Loss of Centromere Cohesion in Aneuploid Human Oocytes Correlates with Decreased Kinetochore Localization of the Sac Proteins Bub1 and Bubr1. Lagirand-Cantaloube J, Ciabrini C, Charrasse S, Ferrieres A, Castro A, Anahory T, Lorca T. Sci Rep. 7:44001. Pubmed
2016
- CDK1 Prevents Unscheduled PLK4-STIL Complex Assembly in Centriole Biogenesis. Zitouni S, Francia ME, Leal F, Montenegro Gouveia S, Nabais C, Duarte P, Gilberto S, Brito D, Moyer T, Kandels-Lewis S, Ohta M, Kitagawa D, Holland AJ, Karsenti E, Lorca T, Lince-Faria M, Bettencourt-Dias M. Curr Biol. 26:1127-37. Pubmed
- The master Greatwall kinase, a critical regulator of mitosis and meiosis. Vigneron S, Robert P, Hached K, Sundermann L, Charrasse S, Labbé JC, Castro A, Lorca T. Int J Dev Biol. 60:245-254. Pubmed
- Greatwall dephosphorylation and inactivation upon mitotic exit is triggered by PP1. Ma S, Vigneron S, Robert P, Strub JM, Cianferani S, Castro A, Lorca T. J Cell Sci. 129:1329-39. Pubmed
2015
- Greatwall promotes cell transformation by hyperactivating AKT in human malignancies. Vera J, Lartigue L, Vigneron S, Gadea G, Gire V, Del Rio M, Soubeyran I, Chibon F, Lorca T, Castro A. 4:e10115. Pubmed
- Global Phosphoproteomic Mapping of Early Mitotic Exit in Human Cells Identifies Novel Substrate Dephosphorylation Motifs. McCloy RA, Parker BL, Rogers S, Chaudhuri R, Gayevskiy V, Hoffman NJ, Ali N, Watkins DN, Daly RJ, James DE, Lorca T, Castro A, Burgess A. Mol Cell Proteomics. 14:2194-212. Pubmed
2014
- Partial inhibition of Cdk1 in G 2 phase overrides the SAC and decouples mitotic events. McCloy RA, Rogers S, Caldon CE, Lorca T, Castro A, Burgess A. Cell Cycle. 13:1400-12. Pubmed
2013
- Greatwall is essential to prevent mitotic collapse after nuclear envelope breakdown in mammals. Álvarez-Fernández M, Sánchez-Martínez R, Sanz-Castillo B, Gan PP, Sanz-Flores M, Trakala M, Ruiz-Torres M, Lorca T, Castro A, Malumbres M. Proc Natl Acad Sci U S A. 110(43):17374-9. Pubmed
- Budding yeast greatwall and endosulfines control activity and spatial regulation of PP2A(Cdc55) for timely mitotic progression. Juanes MA, Khoueiry R, Kupka T, Castro A, Mudrak I, Ogris E, Lorca T, Piatti S. PLoS Genet. 9(7):e1003575. Pubmed
2012
- Quantitative live imaging of endogenous DNA replication in mammalian cells. Burgess A, Lorca T, Castro A. PLoS One. 7(9):e45726. Pubmed
- Deciphering the New Role of the Greatwall/PP2A Pathway in Cell Cycle Control. Lorca T, Castro A. Genes Cancer. 3(11-12):712-20. Pubmed
- CDK-dependent potentiation of MPS1 kinase activity is essential to the mitotic checkpoint. Morin V, Prieto S, Melines S, Hem S, Rossignol M, Lorca T, Espeut J, Morin N, Abrieu A. Curr Biol. 22(4):289-95. Pubmed
2011
- Characterization of the mechanisms controlling Greatwall activity. Vigneron S, Gharbi-Ayachi A, Raymond AA, Burgess A, Labbé JC, Labesse G, Monsarrat B, Lorca T, Castro A. Mol Cell Biol. 31(11):2262-75. Pubmed
- [Greatwall, a new guardian of mitosis].[Article in French] Gharbi-Ayachi A, Burgess A, Vigneron S, Labbé JC, Castro A, Lorca T. Med Sci (Paris). 27(4):352-4. Pubmed
2010
- Loss of human Greatwall results in G2 arrest and multiple mitotic defects due to deregulation of the cyclin B-Cdc2/PP2A balance. Burgess A, Vigneron S, Brioudes E, Labbé JC, Lorca T, Castro A. Proc Natl Acad Sci U S A. 107(28):12564-9. Pubmed
- Constant regulation of both the MPF amplification loop and the Greatwall-PP2A pathway is required for metaphase II arrest and correct entry into the first embryonic cell cycle. Lorca T, Bernis C, Vigneron S, Burgess A, Brioudes E, Labbé JC, Castro A. J Cell Sci. 123(Pt 13):2281-91. Pubmed
- The substrate of Greatwall kinase, Arpp19, controls mitosis by inhibiting protein phosphatase 2A. Gharbi-Ayachi A, Labbé JC, Burgess A, Vigneron S, Strub JM, Brioudes E, Van-Dorsselaer A, Castro A, Lorca T. Science. 330(6011):1673-7. Pubmed
2009
- Greatwall maintains mitosis through regulation of PP2A. Vigneron S, Brioudes E, Burgess A, Labbé JC, Lorca T, Castro A. EMBO J. 28(18):2786-93. Pubmed
Phosphatases dans le cycle cellulaire et la signalisation

 Anna CASTRO et Thierry LORCA
Anna CASTRO et Thierry LORCA
Chefs d’équipe (Directrice et Directeur de Recherche DR1 CNRS)
Membres de l’équipe
(Chercheur DR1) +33 (0)4 34 35 95 56 |
|
(Chercheur DR1) +33 (0)4 34 35 95 56 |
|
(IE-Recherche) +33 (0)4 34 35 95 56 |
|
(Chercheur) +33 (0)4 34 35 95 57 |
|
(IE-Recherche) +33 (0)4 34 35 95 57 |
|
(Doctorant) +33 (0)4 34 35 95 57 |
|
(Chercheur) +33 (0)4 34 35 95 56 |
|
(Doctorant) +33 (0)4 34 35 95 57 |
|
(Doctorant) +33 (0)4 34 35 95 57 |
|
(IE-Recherche) +33 (0)4 34 35 95 56 |
|
(Stagiaire) +33 (0)4 34 35 95 56 |
|
(Stagiaire) +33 (0)4 34 35 95 56 |
|
(Stagiaire) +33 (0)4 34 35 95 57 |
|
(Stagiaire) +33 (0)4 34 35 95 56 |

Contactez notre équipe
Remplacez le nom et l’adresse ci-dessus par celui du membre à contacter
prenom.nom@crbm.cnrs.fr









