Notre recherche
Les Wolbachia sont les endosymbiontes les plus répandus sur Terre, présents dans la majorité des espèces d’arthropodes terrestres et dans les nématodes filaires parasites.
Nous nous intéressons aux mécanismes à l’origine de ce succès évolutif:
Mécanismes de l’incompatibilité cytoplasmique induite par Wolbachia :
Les Wolbachia sont les endosymbiontes les plus répandus sur Terre, présents dans la majorité des espèces d’arthropodes terrestres et dans les nématodes filaires. Nous nous intéressons aux mécanismes qui sous-tendent ce succès évolutif.
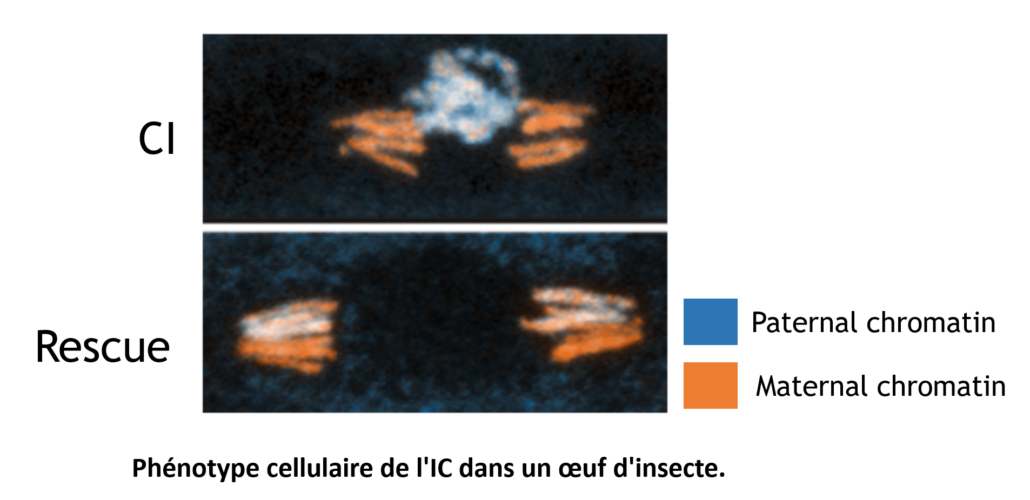
Les bactéries Wolbachia sont très répandues chez les espèces d’arthropodes terrestres grâce à de puissantes stratégies de manipulation de la reproduction de leurs hôtes qui assurent leur transmission matrilinéaire. La plus courante, appelée Incompatibilité Cytoplasmique (CI), est un syndrome de stérilité conditionnelle reposant sur un système toxine-antitoxine sécrété (CidB et CidA) et se produisant lorsqu’un mâle infecté par Wolbachia féconde une femelle non infectée ou porteuse d’une autre souche de Wolbachia incompatible. Les œufs fécondés résultant de ce croisement CI s’arrêtent généralement à un stade très précoce de leur développement, en raison de défauts de ségrégation des chromosomes paternels lors de la première division zygotique. Lorsque la femelle hôte est infectée par une souche compatible de Wolbachia, le développement est restauré et les Wolbachia sont transmises avec succès au travers des œufs.
En favorisant les femelles infectées par rapport aux femelles non infectées, le CI permet la transmission et la propagation de Wolbachia au sein de populations d’arthropodes. Afin de comprendre les mécanismes détaillés du système toxine-antitoxine (TA) sur lequel repose l’incompatibilité cytoplasmique, nous avons développé des modèles de cellules d’insectes et de levures et nous étudions actuellement en détail comment la réplication de l’ADN est perturbée par la toxine CidB, en collaboration avec les équipes Loppin (ENS), Schwob (IGMM) et Weill (ISEM).
Études comparatives sur la symbiose pour comprendre le CI.
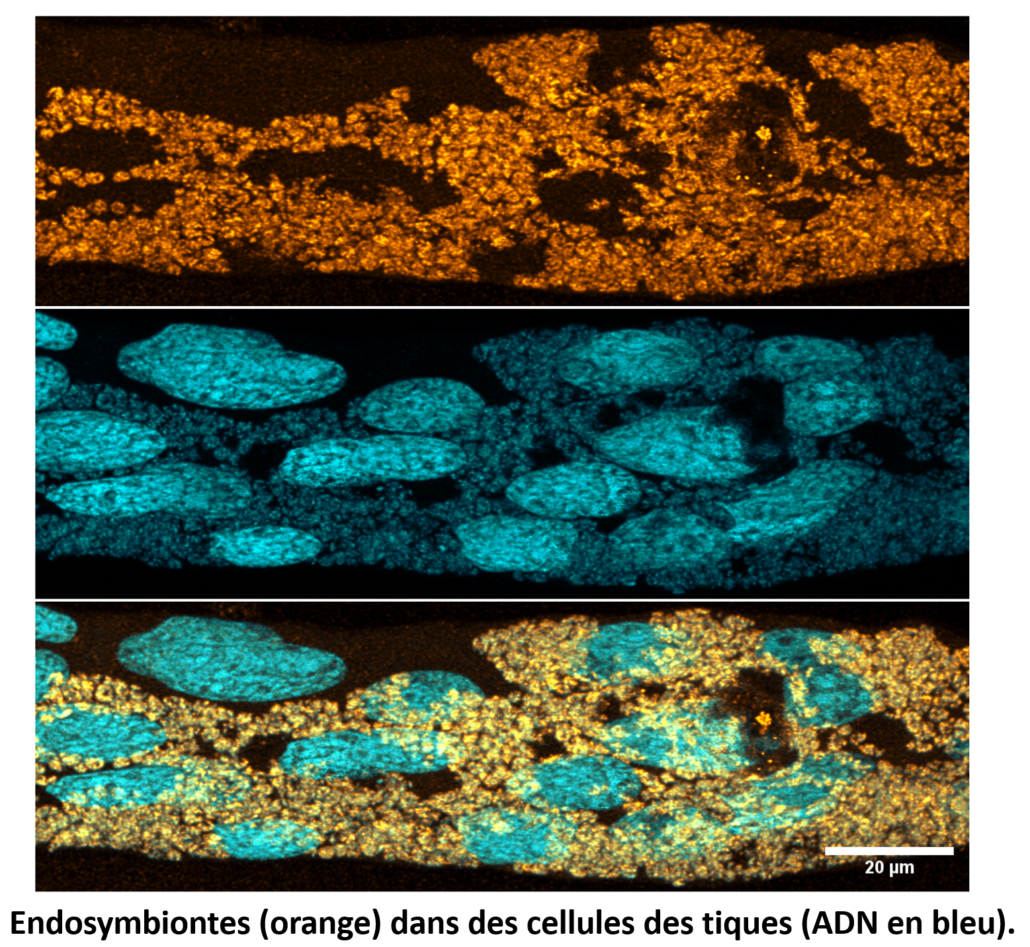
La réplication de l’ADN est-elle toujours la cible du CI ? D’autres symbiotes induisent le CI avec des systèmes TA putatifs, tels que les symbiotes Rickettsia et Ricketsiella. Nous explorons ces mécanismes inconnus de CI chez des espèces de tiques, en collaboration avec l’équipe Duron (IRD).
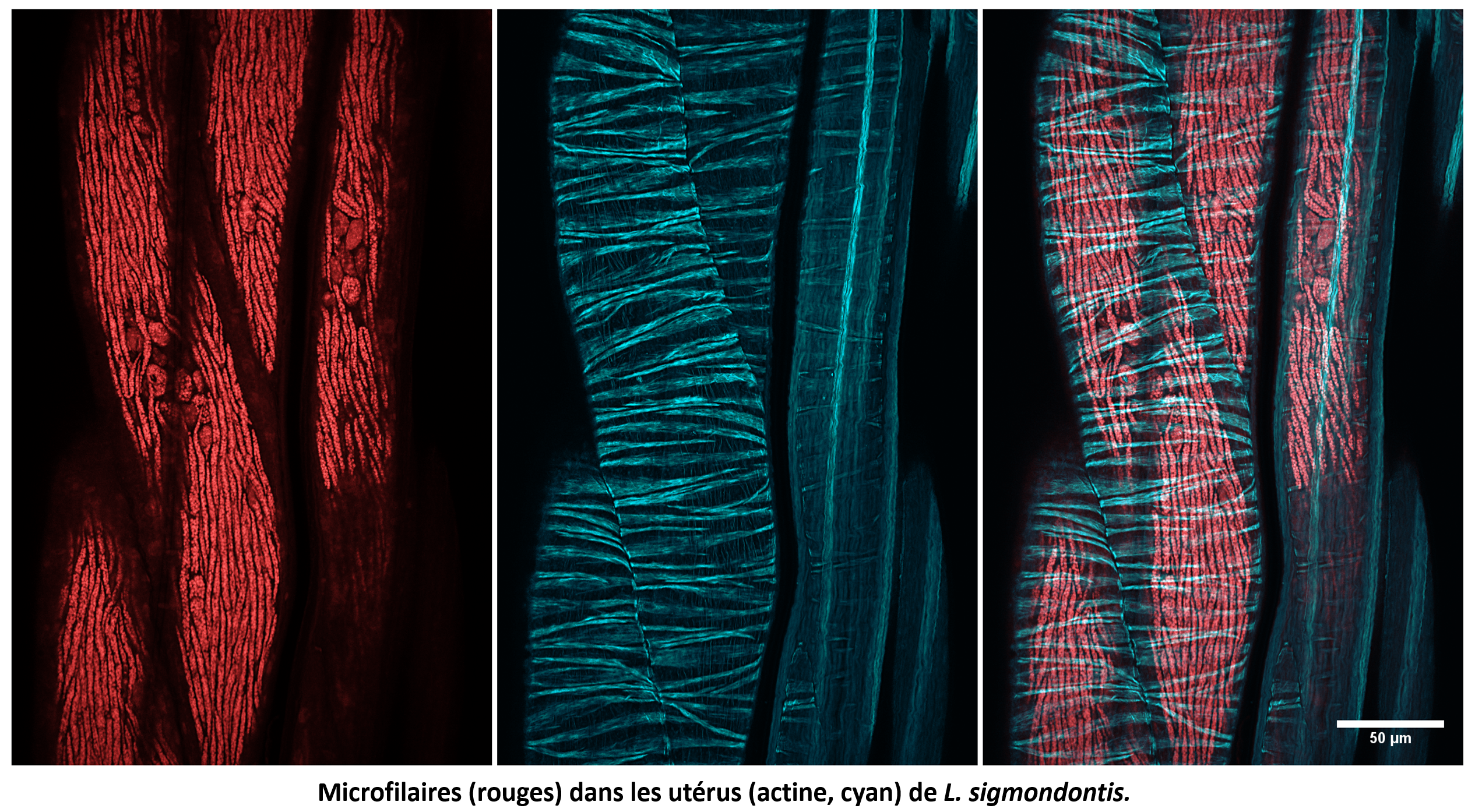
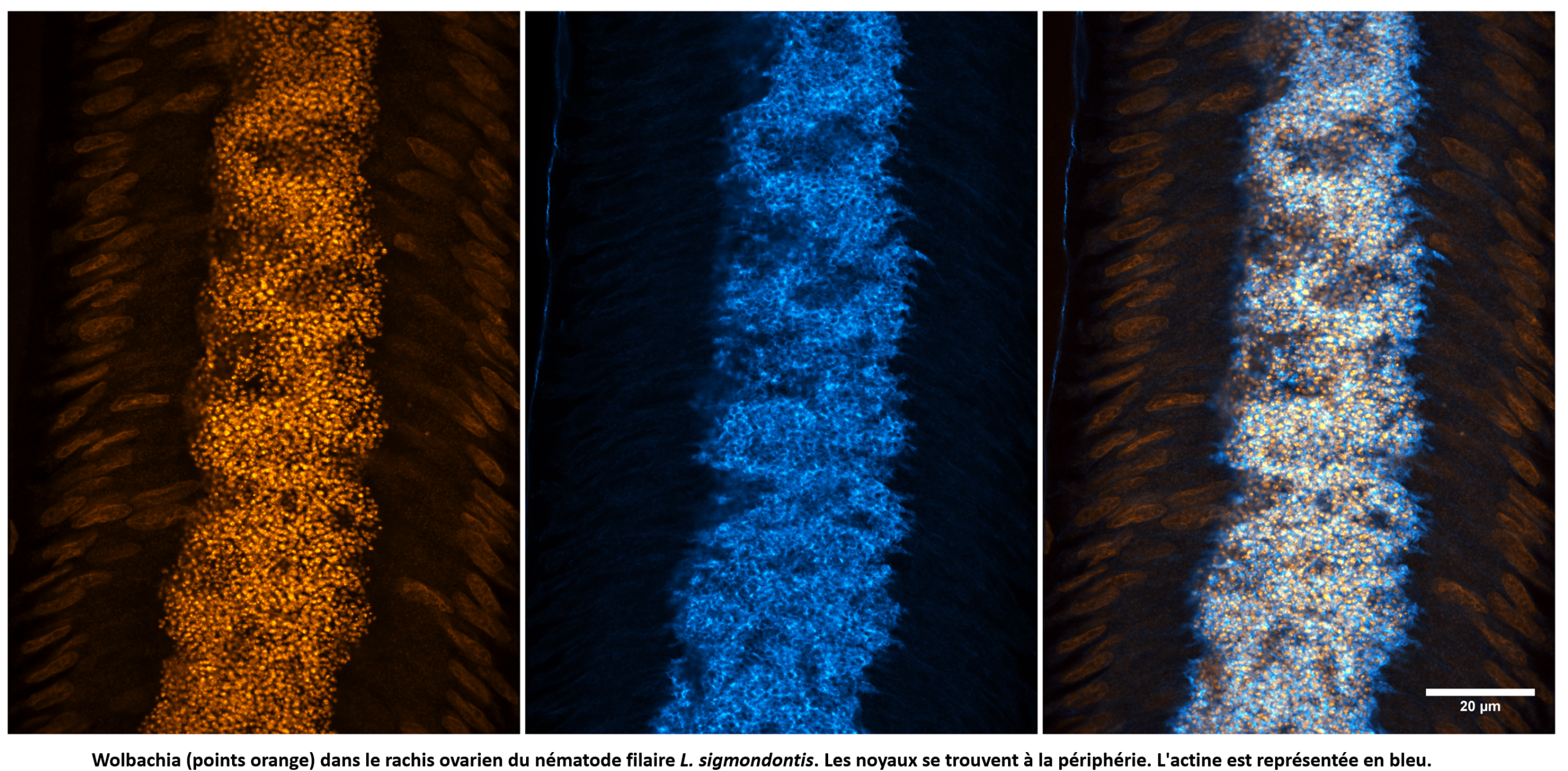
Le mutualisme de Wolbachia chez les nématodes parasites filaires : quels sont les rôles cellulaires et développementaux de Wolbachia chez ces vers?
Les nématodes filaires sont transmis par des arthropodes hématophages aux vertébrés terrestres. Provoquant des maladies très invalidantes chez l’homme et même mortelles pour certains animaux, toutes les espèces filaires d’intérêt biomédical, à l’exception d’une seule, vivent en symbiose mutualiste avec Wolbachia. L’élimination de Wolbachia par traitement antibiotique conduit à la stérilité du ver et réduit considérablement la durée de vie. Pendant longtemps, la biologie cellulaire des filaires s’est limitée à l’immunohistochimie sur des coupes transversales, peu informative. Nous avons développé des approches cellulaires/développementales et des techniques de séquençage d’ARN sur des tissus disséqués afin d’étudier le rôle de Wolbachia dans cette symbiose mutualiste, en nous concentrant sur le rôle de Wolbachia dans la lignée germinale.
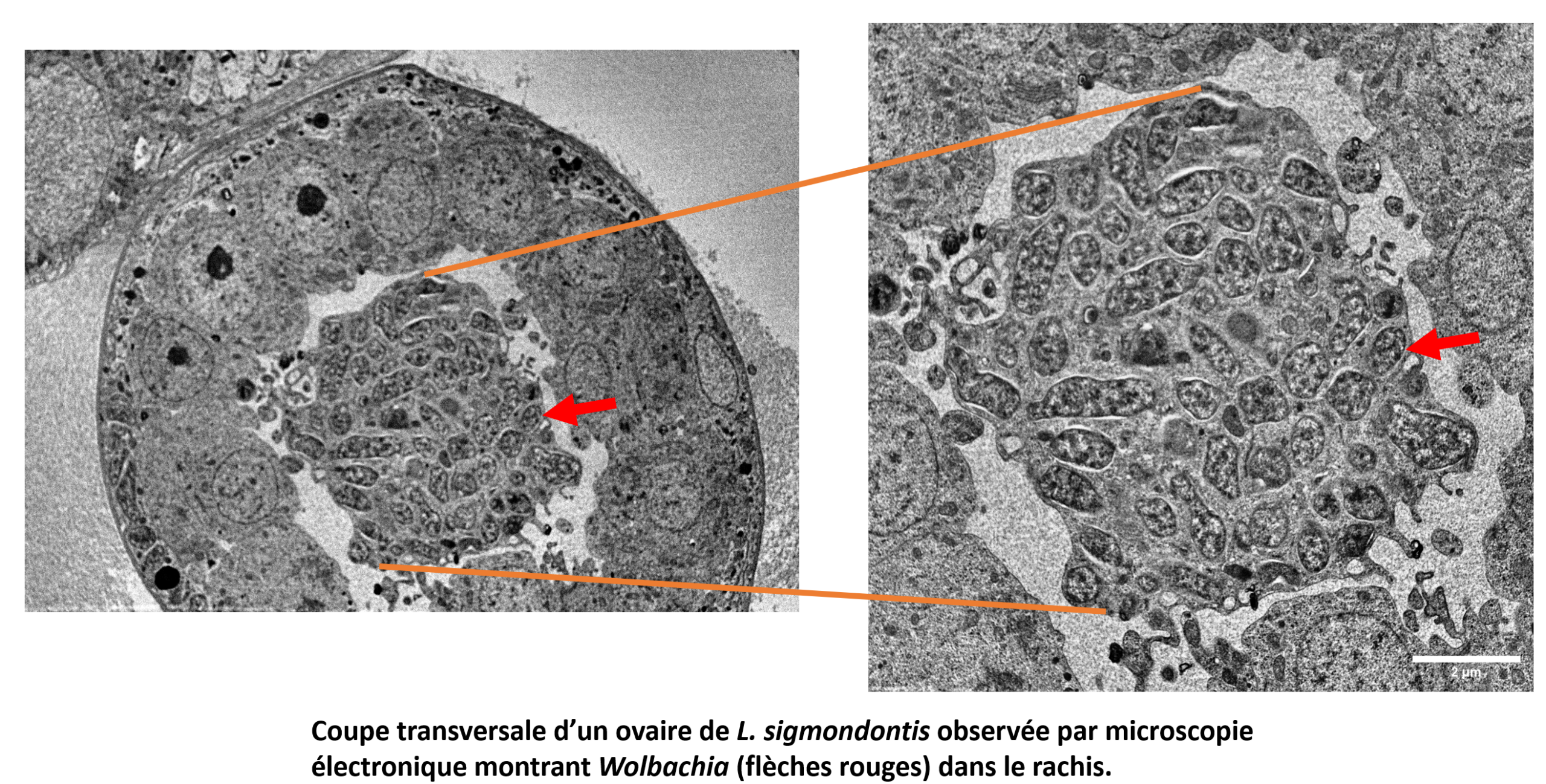

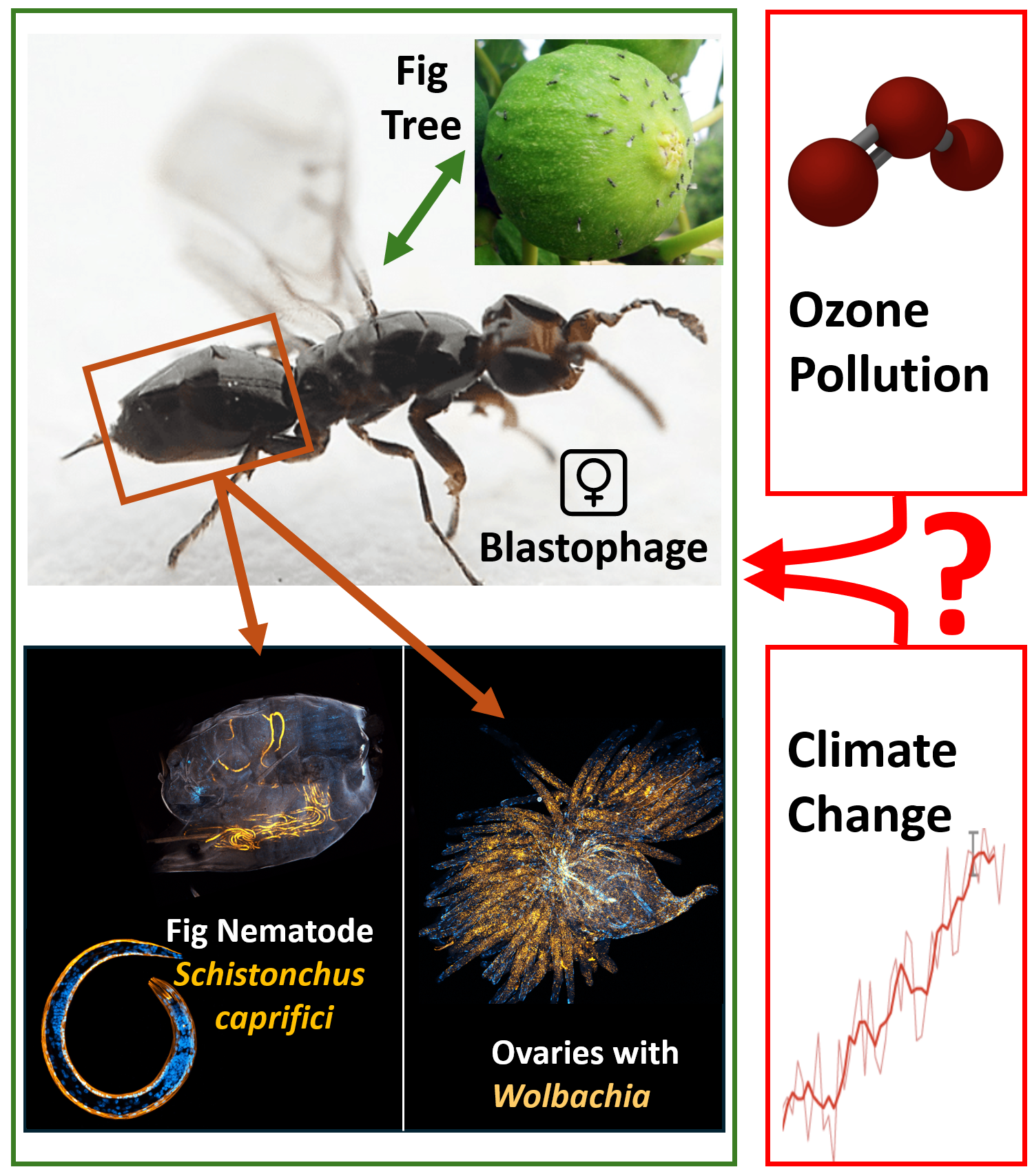
Effets environnementaux sur les interactions parasitaires complexes : caractérisation de la symbiose entre la guêpe Blastophage et Wolbachia, entre la guêpe et le nématode Schistonchus, et influence de la température et de la pollution par l’ozone:
Nous avons établi que le pollinisateur du figuier, Blastophaga psenes, est infecté par Wolbachia. Cette guêpe est également le vecteur des nématodes Schistonchus caprifici. Nous analysons ces interactions à l’aide de matériel sauvage (collecté sur des caprifiguiers dans la campagne montpelliéraine) et caractérisons le cycle de vie de ces nématodes qui oscille entre la figue et le blastophage. En collaboration avec Finn Kjellberg et Magali Proffit (CEFE), nous étudions les effets néfastes de la pollution par l’ozone et de l’augmentation de la température. Lorsque ces organismes sont exposés à de telles conditions, non seulement l’interaction entre les plantes et les pollinisateurs est perdue, mais la létalité des larves/nymphes de Blastophage augmente, ce qui suggère des impacts possibles sur la reproduction des adultes survivants. Dans l’ensemble, l’interaction figuier / blastophage /Wolbachia / Schistonchus constitue un modèle exceptionnel pour étudier et rendre compte des effets hautement néfastes de l’ozone à différentes échelles dans la nature, en se concentrant sur la reproduction et le développement de ces espèces interconnectées.
En savoir plus
N’hésitez pas à nous contacter!
Financements
ANR WOLF (01/10/2021 – 30/09/2025)
ANR CYTOTIKS (01/10/2025 – 30/09/2029)
Publications
2025
- Host environment shapes filarial parasite fitness and Wolbachia endosymbionts dynamics. Fercoq F, Cormerais C, Remion E, Gal J, Plisson J, Fall A, Alonso J, Lhermitte-Vallarino N, Hübner MP, Kohl L, Landmann F, Martin C. PLoS Pathog. 2025 Jul 11;21(7):e1013301. Pubmed
- Recombination, truncation and horizontal transfer shape the diversity of Wolbachia-induced cytoplasmic incompatibility patterns. Namias A, Martinez J, Boussou I, Terretaz K, Conner W, Justy F, Makoundou P, Perriat-Sanguinet M, Labbé P, Sicard M, Landmann F, Weill M. Mol Biol Evol. 2025 Aug 12:msaf200. Pubmed
2022
- Paternal transmission of the Wolbachia CidB toxin underlies cytoplasmic incompatibility. Horard B, Terretaz K, Gosselin-Grenet AS, Sobry H, Sicard M, Landmann F, Loppin B. Curr Biol. 2022 Mar 28;32(6):1319-1331.e5. Pubmed
- A qPCR to quantify Wolbachia from few Onchocerca volvulus microfilariae as a surrogate for adult worm histology in clinical trials of antiwolbachial drugs. Schlabe S, Korir P, Lämmer C, Landmann F, Dubben B, Koschel M, Albers A, Debrah LB, Debrah AY, Hübner MP, Pfarr K, Klarmann-Schulz U, Hoerauf A. Parasitol Res. 2022 Jan 10. Epub ahead of print. Pubmed
2021
- Cytoplasmic Incompatibility Variations in Relation with Wolbachia cid Genes Divergence in Culex pipiens. Sicard M, Namias A, Perriat-Sanguinet M, Carron E, Unal S, Altinli M, Landmann F, Weill M. mBio. 12(1):e02797-20 Pubmed
- Dual RNAseq analyses at soma and germline levels reveal evolutionary innovations in the elephantiasis-agent Brugia malayi, and adaptation of its Wolbachia endosymbionts. Chevignon G, Foray V, Pérez-Jiménez MM, Libro S, Chung M, Foster JM, Landmann F. PLoS Negl Trop Dis. 15(1):e0008935 Pubmed
2019
- IL-4 receptor dependent expansion of lung CD169+ macrophages in microfilaria-driven inflammation. Fercoq F, Remion E, Frohberger SJ, Vallarino-Lhermitte N, Hoerauf A, Le Quesne J, Landmann F, Hübner MP, Carlin LM, Martin C. PLoS Negl Trop Dis ;13(8):e0007691 Pubmed
- Discovery of short-course antiwolbachial quinazolines for elimination of filarial worm infections. Bakowski MA, Shiroodi RK, Liu R, Olejniczak J, Yang B, Gagaring K, Guo H, White PM, Chappell L, Debec A, Landmann F, Dubben B, Lenz F, Struever D, Ehrens A, Frohberger SJ, Sjoberg H, Pionnier N, Murphy E, Archer J, Steven A, Chunda VC, Fombad FF, Chounna PW, Njouendou AJ, Metuge HM, Ndzeshang BL, Gandjui NV, Akumtoh DN, Kwenti TDB, Woods AK, Joseph SB, Hull MV, Xiong W, Kuhen KL, Taylor MJ, Wanji S, Turner JD, Hübner MP, Hoerauf A, Chatterjee AK, Roland J, Tremblay MS, Schultz PG, Sullivan W, Chu XJ, Petrassi HM, McNamara CW. Sci Transl Med ;11(491):eaav3523 Pubmed
- Wolbachia endosymbionts subvert the endoplasmic reticulum to acquire host membranes without triggering ER stress. Fattouh N, Cazevieille C, Landmann F. PLoS Negl Trop Dis. 13(3):e0007218. Pubmed
- The Wolbachia Endosymbionts. Landmann F. Microbiol Spectr. 7(2). Pubmed
2018
- The cellular phenotype of cytoplasmic incompatibility in Culex pipiens in the light of cidB diversity. Manon Bonneau, Frédéric Landmann, Pierrick Labbé, Fabienne Justy, Mylène Weill, Mathieu Sicard. PLoS Pathog; 14(10):e1007364. Pubmed
- Wolbachia Control Stem Cell Behavior and Stimulate Germline Proliferation in Filarial Nematodes. Foray V, Pérez-Jiménez MM, Fattouh N, Landmann F. Dev Cell. 45(2):198-211. Pubmed
2016
- Non-centrosomal epidermal microtubules act in parallel to LET-502/ROCK to promote C. elegans elongation. Quintin S, Wang S, Pontabry J, Bender A, Robin F, Hyenne V, Landmann F, Gally C, Oegema K, Labouesse M. Development. 143:160-73. Pubmed
2014
- Drosophila protamine-like Mst35Ba and Mst35Bb are required for proper sperm nuclear morphology but are dispensable for male fertility. Tirmarche S, Kimura S, Sapey-Triomphe L, Sullivan W, Landmann F, Loppin B. G3 (Bethesda). 4:2241-5. Pubmed
- Co-evolution between an endosymbiont and its nematode host: Wolbachia asymmetric posterior localization and AP polarity establishment. Landmann F, Foster JM, Michalski ML, Slatko BE, Sullivan W. PLoS Negl Trop Dis. 28:e3096. Pubmed
- Absence of Wolbachia endobacteria in the human parasitic nematode Dracunculus medinensis and two related Dracunculus species infecting wildlife. Foster JM, Landmann F, Ford L, Johnston KL, Elsasser SC, Schulte-Hostedde AI, Taylor MJ, Slatko BE. Parasit Vectors. 7:140. Pubmed
2013
- Interdomain lateral gene transfer of an essential ferrochelatase gene in human parasitic nematodes. Wu B, Novelli J, Jiang D, Dailey HA, Landmann F, Ford L, Taylor MJ, Carlow CK, Kumar S, Foster JM, Slatko BE. Proc Natl Acad Sci U S A. 110(19):7748-53. Pubmed
2012
- Efficient in vitro RNA interference and immunofluorescence-based phenotype analysis in a human parasitic nematode, Brugia malayi. Landmann F, Foster JM, Slatko BE, Sullivan W. Parasit Vectors. 5:16. Pubmed
- A cell-based screen reveals that the albendazole metabolite, albendazole sulfone, targets Wolbachia. Serbus LR, Landmann F, Bray WM, White PM, Ruybal J, Lokey RS, Debec A, Sullivan W. PLoS Pathog. 8(9):e1002922. Pubmed
- A new type F Wolbachia from Splendidofilariinae (Onchocercidae) supports the recent emergence of this supergroup. Lefoulon E, Gavotte L, Junker K, Barbuto M, Uni S, Landmann F, Laaksonen S, Saari S, Nikander S, de Souza Lima S, Casiraghi M, Bain O, Martin C. Int J Parasitol. 42(11):1025-36. Pubmed
- Both asymmetric mitotic segregation and cell-to-cell invasion are required for stable germline transmission of Wolbachia in filarial nematodes. Landmann F, Bain O, Martin C, Uni S, Taylor MJ, Sullivan W. Biol Open. 1(6):536-47. Pubmed
2011
- A tension-induced mechanotransduction pathway promotes epithelial morphogenesis. Zhang H, Landmann F, Zahreddine H, Rodriguez D, Koch M, Labouesse M. Nature. 471(7336):99-103. Pubmed
- New insights into the evolution of Wolbachia infections in filarial nematodes inferred from a large range of screened species. Ferri E, Bain O, Barbuto M, Martin C, Lo N, Uni S, Landmann F, Baccei SG, Guerrero R, de Souza Lima S, Bandi C, Wanji S, Diagne M, Casiraghi M. PLoS One. 6(6):e20843. Pubmed
- Anti-filarial activity of antibiotic therapy is due to extensive apoptosis after Wolbachia depletion from filarial nematodes. Landmann F, Voronin D, Sullivan W, Taylor MJ. PLoS Pathog. 7(11):e1002351. Pubmed
2010
- Asymmetric Wolbachia segregation during early Brugia malayi embryogenesis determines its distribution in adult host tissues. Landmann F, Foster JM, Slatko B, Sullivan W. PLoS Negl Trop Dis. 4(7):e758. Pubmed
2009
- Wolbachia-mediated cytoplasmic incompatibility is associated with impaired histone deposition in the male pronucleus. Landmann F, Orsi GA, Loppin B, Sullivan W. PLoS Pathog. 5(3):e1000343. Pubmed
- Myosin II regulation during C. elegans embryonic elongation: LET-502/ROCK, MRCK-1 and PAK-1, three kinases with different roles. Gally C, Wissler F, Zahreddine H, Quintin S, Landmann F, Labouesse M. Development. 136(18):3109-19. Pubmed
2008
- The genetics and cell biology of Wolbachia-host interactions. Serbus LR, Casper-Lindley C, Landmann F, Sullivan W. Annu Rev Genet. 42:683-707. Pubmed
Mécanismes de symbiose avec Wolbachia

Frédéric Landmann
Chef d’équipe (Chercheur DR2 CNRS)
Membres de l’équipe
(Chercheur DR2) +33 (0)4 34 35 95 65 |
|
(IE-Recherche) +33 (0)4 34 35 95 66 |
|
(Stagiaire) +33 (0)4 34 35 95 65 |
|
(IE-Recherche) +33 (0)4 34 35 9 |
Contactez notre équipe
Remplacez le nom et l’adresse ci-dessus par celui du membre à contacter
prenom.nom@crbm.cnrs.fr








