
Notre recherche
RÉSUMÉ
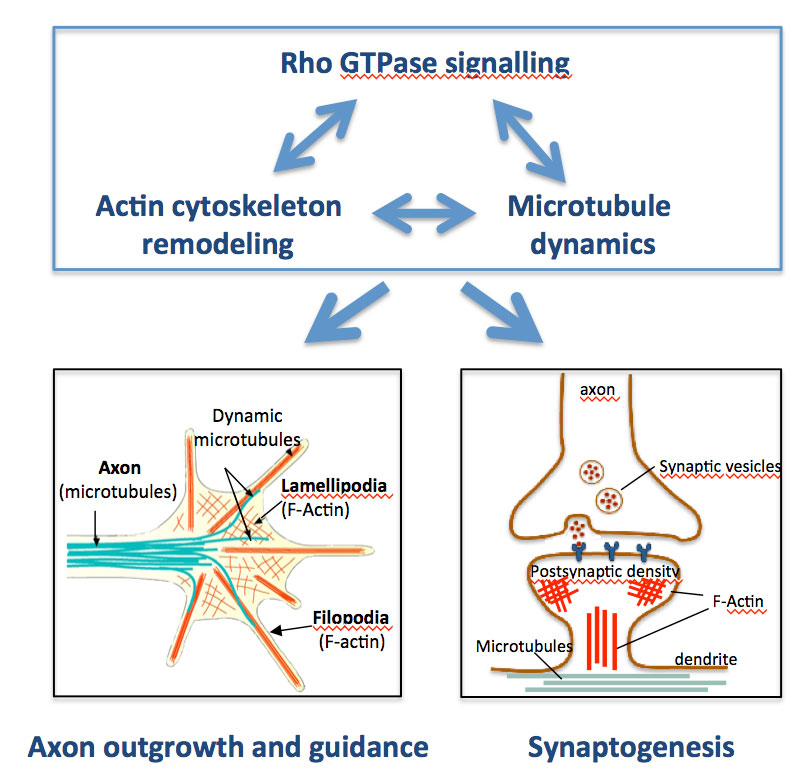
La connectivité neuronale repose sur des processus de développement complexes, tels que la croissance et le guidage des axones, l’arborisation dendritique et la synaptogenèse. Ces processus reposent sur la coordination du remodelage du cytosquelette d’actine et de la dynamique des microtubules. Les Rho GTPases sont des acteurs majeurs de la morphogenèse neuronale car elles contrôlent le remodelage du cytosquelette d’actine. Notre intérêt à long terme est de comprendre comment la signalisation des Rho GTPases contrôle la croissance et le guidage des axones ainsi que la synaptogenèse. La perturbation de ces processus peut conduire à des maladies neurologiques, telles que la schizophrénie, les troubles du spectre autistique (TSA) et la déficience intellectuelle (DI). Par conséquent, une meilleure connaissance de ces mécanismes moléculaires permettra d’améliorer la compréhension et le diagnostic des maladies neurologiques liées à des défauts dans ces processus.
QUESTIONS
Nous utilisons différentes méthodes complémentaires de biochimie et de biologie cellulaire et une approche intégrée avec des modèles de souris transgéniques pour répondre aux questions suivantes:
• Quelles sont les fonctions de la signalisation des GTPases Rho dans la croissance axonale et la synaptogenèse?
• Comment ces protéines sont-elles régulées au cours de ces processus?
• Comment ces protéines contribuent-elles à la coordination entre le remodelage du cytosquelette d’actine et la dynamique des microtubules?
• Comment la dérégulation de la signalisation des GTPases Rho peut-elle contribuer aux maladies neurologiques?
PROJETS
i) La signalisation des GTPases Rho et la croissance axonale. Les GTPases de la famille Rho sont des commutateurs moléculaires qui sont activés par des facteurs d’échange (GEF) et inactivés par des GAPs. Plusieurs laboratoires incluant le notre ont montré que le RhoGEF Trio est un régulateur majeur de la migration cellulaire et la croissance axonale en contrôlant le remodelage du cytosquelette d’actine par l’activation de la GTPase Rac1. Nous avons découvert récemment un lien direct inattendu entre Trio et des protéines impliquées dans le contrôle de la dynamique des microtubules (MT). Nous avons démontré que la capacité de la liaison de Trio aux MT est essentielle pour sa fonction dans la croissance axonale. Notre travail actuel vise à déchiffrer les mécanismes moléculaires qui régulent le lien entre Trio, le remodelage du cytosquelette d’actine et la dynamique des MT au cours de la croissance axonale.
ii) Signalisation des GTPases Rho et synaptogenèse. Les GTPases Rho participent également à la morphogenèse des épines dendritiques qui forment et établissent des contacts synaptiques pendant le développement du cerveau. Nous avons récemment identifié de nouveaux membres de la signalisation des GTPases Rho qui contribuent à la formation des épines dendritiques, comme le RhoGEF DOCK10. Nous étudions maintenant les mécanismes moléculaires par lesquels ces protéines contrôlent ce processus. En outre, nous testons si la perturbation de la fonction de ces protéines participe au développement des troubles neuronaux.
En savoir plus
Financements
ANR HERC2-DOCKD-Modul (Suzanne Schmidt)
ANR TRIOTISM (Anne Debant)
Publications
2024
- An Anti-Invasive Role for Mdmx through the RhoA GTPase under the Control of the NEDD8 Pathway. Bou Malhab LJ, Schmidt S, Fagotto-Kaufmann C, Pion E, Gadea G, Roux P, Fagotto F, Debant A, Xirodimas DP. Cells. 2024 Sep 28;13(19):1625. Pubmed
2023
- Extending the phenotypes associated with TRIO gene variants in a cohort of 25 patients and review of the literature. Gazdagh G, Hunt D, Gonzalez AMC, Rodriguez MP, Chaudhry A, Madruga M, Vansenne F, Shears D, Curie A, Stattin EL, Anderlid BM, Trajkova S, Angelovska ES, McWilliam C, Wyatt PR, O’Driscoll M, Atton G, Bergman AK, Zacher P, Mewasingh LD, López AG, Alonso-Luengo O, Wai HA, Rohde O, Boiroux P, Debant A, Schmidt S, Baralle D. Am J Med Genet A. 2023 Mar 29. Pubmed
- Pathogenic TRIO variants associated with neurodevelopmental disorders perturb the molecular regulation of TRIO and axon pathfinding in vivo. Bonnet M, Roche F, Fagotto-Kaufmann C, Gazdagh G, Truong I, Comunale F, Barbosa S, Bonhomme M, Nafati N, Hunt D, Rodriguez MP, Chaudhry A, Shears D, Madruga M, Vansenne F, Curie A, Kajava AV, Baralle D, Fassier C, Debant A, Schmidt S. Mol Psychiatry. 2023 Jan 30. Pubmed
2020
- The +TIP Navigator-1 Is an Actin-Microtubule Crosslinker That Regulates Axonal Growth Cone Motility. Carlos Sánchez-Huertas, Marion Bonhomme, Amandine Falco, Christine Fagotto-Kaufmann, Jeffrey van Haren, Freddy Jeanneteau, Niels Galjart, Anne Debant, Jérôme Boudeau. J Cell Biol . 2020 Sep 7;219(9):e201905199. Pubmed
- Opposite Modulation of RAC1 by Mutations in TRIO Is Associated with Distinct, Domain-Specific Neurodevelopmental Disorders. Barbosa S, Greville-Heygate S, Bonnet M, Godwin A, Fagotto-Kaufmann C, Kajava AV, Laouteouet D, Mawby R, Wai HA, Dingemans AJM, Hehir-Kwa J, Willems M, Capri Y, Mehta SG, Cox H, Goudie D, Vansenne F, Turnpenny P, Vincent M, Cogné B, Lesca G, Hertecant J, Rodriguez D, Keren B, Burglen L, Gérard M, Putoux A; C4RCD Research Group, Cantagrel V, Siquier-Pernet K, Rio M, Banka S, Sarkar A, Steeves M, Parker M, Clement E, Moutton S, Tran Mau-Them F, Piton A, de Vries BBA, Guille M, Debant A, Schmidt S, Baralle D. Am J Hum Genet. 2020 Mar 5;106(3):338-355. Pubmed
2018
- Group-I PAKs-mediated phosphorylation of HACE1 at serine 385 regulates its oligomerization state and Rac1 ubiquitination. Acosta MI, Urbach S, Doye A, Ng YW, Boudeau J, Mettouchi A, Debant A, Manser E, Visvikis O, Lemichez E. Sci Rep. 2018 Jan 23;8(1):1410. Pubmed
2017
- Recurrent TRIO Fusion in Nontranslocation-Related Sarcomas. Delespaul L, Lesluyes T, Pérot G, Brulard C, Lartigue L, Baud J, Lagarde P, Le Guellec S, Neuville A, Terrier P, Vince-Ranchère D, Schmidt S, Debant A, Coindre JM, Chibon F. Clin Cancer Res. 2017 Feb 1;23(3):857-867. Pubmed
2016
- Mutations specific to the Rac-GEF domain of TRIO cause intellectual disability and microcephaly. Pengelly RJ, Greville-Heygate S, Schmidt S, Seaby EG, Jabalameli MR, Mehta SG, Parker MJ, Goudie D, Fagotto-Kaufmann C, Mercer C; DDD Study, Debant A, Ennis S, Baralle D. J Med Genet. 2016-103942. Pubmed
2015
- The RhoGEF DOCK10 is essential for dendritic spine morphogenesis. Jaudon F, Raynaud F, Wehrlé R, Bellanger JM, Doulazmi M, Vodjdani G, Gasman S, Fagni L, Dusart I, Debant A, Schmidt S. Mol Biol Cell. 2015 Jun 1;26(11):2112-27. Pubmed
- Hsc70 chaperone activity underlies Trio GEF function in axon growth and guidance induced by netrin-1. DeGeer J, Kaplan A, Mattar P, Morabito M, Stochaj U, Kennedy TE, Debant A, Cayouette M, Fournier AE, Lamarche-Vane N. J Cell Biol. 2015 Aug 31;210(5):817-32. Pubmed
- Comprehensive prognostic analysis in breast cancer integrating clinical, tumoral, micro-environmental and immunohistochemical criteria. de Mascarel I, Debled M, Brouste V, Mauriac L, Sierankowski G, Velasco V, Croce S, Chibon F, Boudeau J, Debant A, MacGrogan G. 2015 Sep 21;4:528. Pubmed
2014
- Dynamic microtubules catalyze formation of navigator-TRIO complexes to regulate neurite extension. van Haren J, Boudeau J, Schmidt S, Basu S, Liu Z, Lammers D, Demmers J, Benhari J, Grosveld F, Debant A, Galjart N. Curr Biol. 2014 Aug 4;24(15):1778-85. Pubmed
- Function and regulation of the Rho guanine nucleotide exchange factor Trio. Schmidt S, Debant A. Small GTPases. 2014;5:e29769. Pubmed
- Identification of a mitotic Rac-GEF, Trio, that counteracts MgcRacGAP function during cytokinesis. Cannet A, Schmidt S, Delaval B, Debant A. Mol Biol Cell. 2014 Dec 15;25(25):4063-71. Pubmed
2013
- A genome-wide RNAi screen reveals a Trio-regulated Rho GTPase circuitry transducing mitogenic signals initiated by G protein-coupled receptors. Vaqué JP, Dorsam RT, Feng X, Iglesias-Bartolome R, Forsthoefel DJ, Chen Q, Debant A, Seeger MA, Ksander BR, Teramoto H, Gutkind JS. Mol Cell. 49(1):94-108. Pubmed
- Tyrosine phosphorylation of the Rho guanine nucleotide exchange factor Trio regulates netrin-1/DCC-mediated cortical axon outgrowth. DeGeer J, Boudeau J, Schmidt S, Bedford F, Lamarche-Vane N, Debant A. Mol Cell Biol. 2013 Feb;33(4):739-51. Pubmed
- Aptamer-derived peptide inhibitors of Rho guanine nucleotide exchange factors. Schmidt S, Debant A. Enzymes. 2013;33 Pt A:147-68. Pubmed
2012
- Random mutagenesis of peptide aptamers as an optimization strategy for inhibitor screening. Bouquier N, Fromont S, Debant A, Schmidt S. Methods Mol Biol. 2012;928:97-118. Pubmed
- The doublecortin-related gene zyg-8 is a microtubule organizer in Caenorhabditis elegans neurons. Bellanger JM, Cueva JG, Baran R, Tang G, Goodman MB, Debant A. J Cell Sci. 2012 Nov 15;125(Pt 22):5417-27. Pubmed
2011
- A Trio-RhoA-Shroom3 pathway is required for apical constriction and epithelial invagination. Plageman TF Jr, Chauhan BK, Yang C, Jaudon F, Shang X, Zheng Y, Lou M, Debant A, Hildebrand JD, Lang RA. 2011 Dec;138(23):5177-88. Pubmed
2010
- Kidins220/ARMS regulates Rac1-dependent neurite outgrowth by direct interaction with the RhoGEF Trio. Neubrand VE, Thomas C, Schmidt S, Debant A, Schiavo G. J Cell Sci. 2010 Jun 15;123(Pt 12):2111-23. Pubmed
2009
- Aptamer-derived peptides as potent inhibitors of the oncogenic RhoGEF Tgat. Bouquier N, Fromont S, Zeeh JC, Auziol C, Larrousse P, Robert B, Zeghouf M, Cherfils J, Debant A, Schmidt S. Chem Biol. 2009 Apr 24;16(4):391-400. Pubmed
2008
- Trio mediates netrin-1-induced Rac1 activation in axon outgrowth and guidance. Briançon-Marjollet A, Ghogha A, Nawabi H, Triki I, Auziol C, Fromont S, Piché C, Enslen H, Chebli K, Cloutier JF, Castellani V, Debant A, Lamarche-Vane N. Mol Cell Biol. 28(7):2314-23. Pubmed
Signalisation et dynamique du cytosquelette

Anne DEBANT
Cheffe d’équipe (Directrice de Recherche DR1 CNRS)
Membres de l’équipe
(IR-Recherche) +33 (0)4 34 35 95 16 |
|
(Chercheur DR1) +33 (0)4 34 35 95 04 |
|
(CRCN) +33 (0)4 34 35 95 16 |
|
(CRCN) +33 (0)4 34 35 95 16 |
|
(Doctorant) +33 (0)4 34 35 95 16 |
|
(Chercheur CRCN) +33 (0)4 34 35 95 16 |
|
(Stagiaire) +33 (0)4 34 35 95 16 |
|
(Stagiaire) +33 (0)4 34 35 95 16 |
|
(Stagiaire) +33 (0)4 34 35 95 16 |
|
(IE-Recherche) +33 (0)4 34 35 95 16 |

Contactez notre équipe
Remplacez le nom et l’adresse ci-dessus par celui du membre à contacter
prenom.nom@crbm.cnrs.fr
.
.







