Our Research
Cellular adhesion processes play a key role in the interaction of each cell with neighboring cells and with the microenvironment. They involve complex dynamics of the cytoskeleton and cell membranes. Disruptions in adhesion processes are associated with pathologies including cancer and osteoporosis.
Our team studies the cellular and molecular mechanisms that control cell adhesion and, in particular, the dynamics of membranes and the cytoskeleton. Our work allows us to understand how deregulations of these mechanisms contribute to the development of human diseases, such as cancer and osteoporosis. We wish to initiate the development of new innovative therapies. Our main axes are:
 Cytoskeletal dynamics underlying the control of bone resorption
Cytoskeletal dynamics underlying the control of bone resorption
(More)
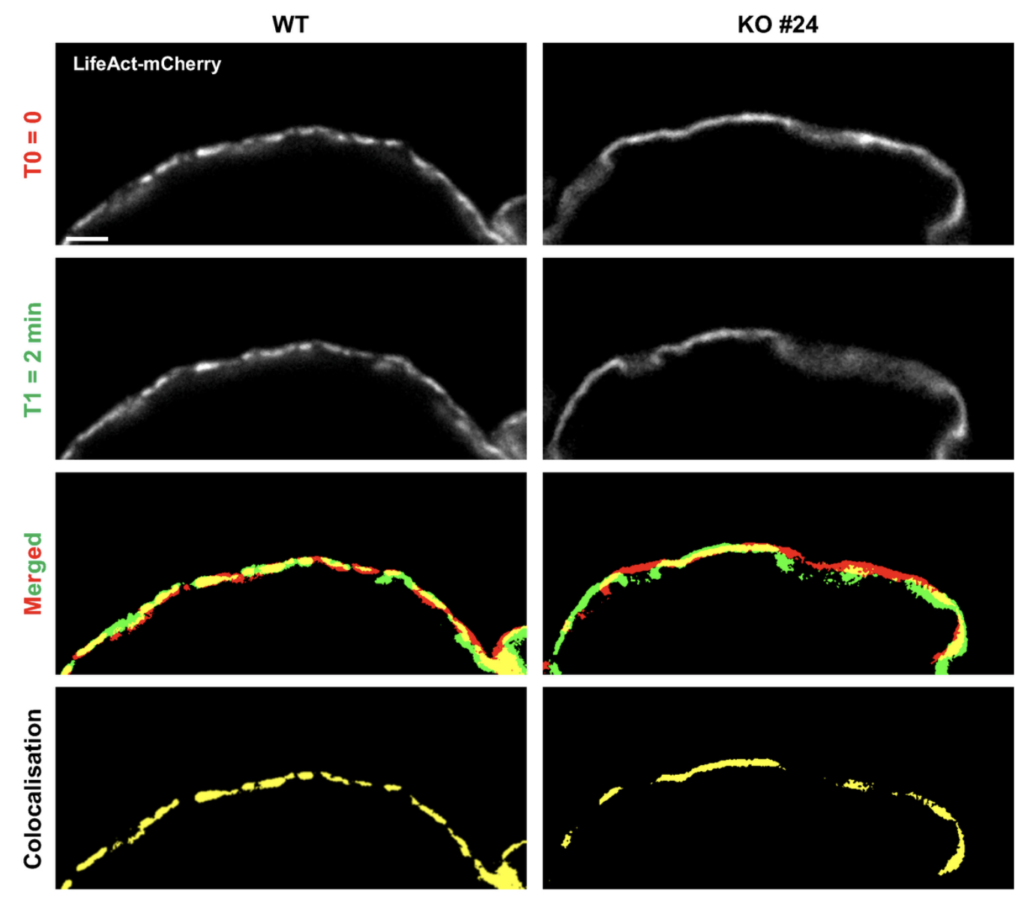
The cytoskeleton of the osteoclast, comprising in particular microtubules and actin filaments, has an essential role to ensure the adhesion of the cell to the bone and to maintain the bone resorption apparatus. This function is crucial to control osteoclast bone resorption activity, which is necessary to preserve bone health. Our recent work has shown that this cytoskeleton can also be used as a therapeutic target to prevent uncontrolled osteoclast activity, which is found in many metabolic, inflammatory or cancerous diseases. Our current work aims to understand how microtubules and actin filaments cooperate to ensure osteoclast adhesion to bone and to control its bone resorption activity.
 Flotillins and tumor invasion
Flotillins and tumor invasion
(More)
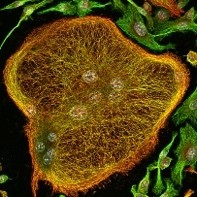
Flotillins are proteins that are overexpressed in many cancers, which favors the invasiveness of tumor cells and is associated with a poor prognosis for patients. Functionally, flotillins are essential to control the membrane trafficking of key proteins in tumor development. Our recent work has shown that membrane receptor trafficking, between the plasma membrane and intracellular compartments, plays a key role in cell response to microenvironment and matrix signals. We are currently seeking to understand the molecular mechanisms by which flotillins control membrane trafficking and how their deregulation leads to aberrant signaling and disruption of cell adhesion, which together promote tumor invasion in different types of cancers.
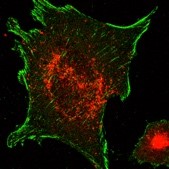 Cellular adhesion and bone formation
Cellular adhesion and bone formation
(More)
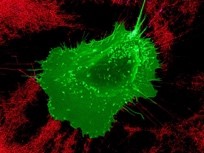
In particular, flotillins are involved in the formation of focal adhesions containing integrin b1 and in the recycling of this integrin. Integrin b1, a key player in cell response to mechanical signals, is essential for the formation and mineralization of bone matrix by osteoblasts. Our recent work has shown that integrin b1 controls vesicular trafficking in osteoblasts in response to matrix stiffness. Our current work focuses on the functional interaction mechanisms between integrin b1 and flotillins, and in particular their involvement in bone formation by osteoblasts.
To answer these questions we use different cell models: osteoblasts, osteoclasts, cells from various types of cancers (osteosarcoma, breast cancer…). We use different methodological approaches: advanced cellular imaging (live cell microscopy, electron microcopy, super resolution, optogenetics), in vivo models in mice or zebrafish and various techniques of genetic modification, biochemistry and cell signaling.
All these approaches allow us to address questions in fundamental cell biology with a focus on the understanding of human pathologies.
Read more
Funding
ANR SUBRNACT (01/10/2023-31/12/2027)
CRBM Apprentie (15/04/2024-31/12/2026)
Ligue Nationale Contre le Cancer (14/11/2024-13/11/2025)
GEFLUC (01/01/2025-28/02/2026)
ANR FLOTAKE (01/10/2022-31/10/2026)
FRM (4ème année de thèse)
Publications
2025
- ARHGAP10 is a novel microtubule-associated protein that regulates the resorption activity of osteoclasts. Jentschel L, Blangy A, Bompard G. J Biol Chem. 2025 Aug 30:11066. Pubmed
- Growth factor-triggered de-sialylation controls glycolipid-lectin-driven endocytosis. MacDonald E, Forrester A, Valades-Cruz CA, Madsen TD, Hetmanski JHR, Dransart E, Ng Y, Godbole R, Shp AA, Leconte L, Chambon V, Ghosh D, Pinet A, Bhatia D, Lombard B, Loew D, Larsen MR, Leffler H, Lefeber DJ, Clausen H, Blangy A, Caswell P, Shafaq-Zadah M, Mayor S, Weigert R, Wunder C, Johannes L. Nat Cell Biol. 2025 Mar;27(3):449-463. Pubmed
- Flotillins in membrane trafficking and physiopathology.. Bodin S, Elhabashy H, Macdonald E, Winter D, Gauthier-Rouvière C. Biol Cell. 2025 Jan;117(1):e2400134.. Pubmed
2024
- Bone resorption by osteoclasts involves fine tuning of RHOA activity by its microtubule-associated exchange factor GEF-H1. Morel A, Douat C, Blangy A, Vives V. Front Physiol. 2024 Jan 19;15:1342024. Pubmed
- BIN1 regulates actin-membrane interactions during IRSp53-dependent filopodia formation.. Picas L, André-Arpin C, Comunale F, Bousquet H, Tsai FC, Rico F, Maiuri P, Pernier J, Bodin S, Nicot AS, Laporte J, Bassereau P, Goud B, Gauthier-Rouvière C, Miserey S. Commun Biol. 2024 May 9;7(1):549. Pubmed
2023
- Protein dynamics at invadopodia control invasion-migration transitions in melanoma cells. Legrand M, Mousson A, Carl P, Rossé L, Justiniano H, Gies JP, Bouvard D, Sick E, Dujardin D, Rondé P. Cell Death Dis. 2023 Mar 11;14(3):190.. Pubmed
2022
- ICAP-1 loss impairs CD8+ thymocyte development and leads to reduced marginal zone B cells in mice. Sevilla-Movilla S, Fuentes P, Rodríguez-García Y, Arellano-Sánchez N, Krenn PW, de Val SI, Montero-Herradón S, García-Ceca J, Burdiel-Herencia V, Gardeta SR, Aguilera-Montilla N, Barrio-Alonso C, Crainiciuc G, Bouvard D, García-Pardo A, Zapata AG, Hidalgo A, Fässler R, Carrasco YR, Toribio ML, Teixidó J. , Eur J Immunol. 2022 Aug;52(8):1228-1242. Pubmed
- Upregulated flotillins and sphingosine kinase 2 derail AXL vesicular traffic to promote epithelial-mesenchymal transition. Genest M, Comunale F, Planchon D, Govindin P, Noly D, Vacher S, Bièche I, Robert B, Malhotra H, Schoenit A, Tashireva LA, Casas J, Gauthier-Rouvière C, Bodin S. J Cell Sci. 2022 Apr 1;135(7):jcs259178. Pubmed
2021
- Staphylococcus aureus internalization impairs osteoblastic activity and early differentiation process. Mouton W, Josse J, Jacqueline C, Abad L, Trouillet-Assant S, Caillon J, Bouvard D, Bouchet M, Laurent F, Diot A. Sci Rep. 2021 Sep 3;11(1):17685. Pubmed
- Structural and functional analysis of LIM domain-dependent recruitment of paxillin to αvβ3 integrin-positive focal adhesions. Ripamonti M, Liaudet N, Azizi L, Bouvard D, Hytönen VP, Wehrle-Haller B. Commun Biol. 2021 Mar 29;4(1):380. Pubmed
- The Beta-Tubulin Isotype TUBB6 Controls Microtubule and Actin Dynamics in Osteoclasts. Justine Maurin, Anne Morel, David Guérit, Julien Cau, Serge Urbach, Anne Blangy, Guillaume Bompard. Frontiers in Cell and Developmental Biology 2021 (9) 3042 Pubmed
2020
- Regulation of invadosomes by microtubules: Not only a matter of railways. Maurin J, Blangy A, Bompard G. Eur J Cell Biol. 2020 Aug 21;99(7):151109. doi: 10.1016/j.ejcb.2020.151109 Pubmed
- Novel 2,7-Diazaspiro[4,4]nonane Derivatives to Inhibit Mouse and Human Osteoclast Activities and Prevent Bone Loss in Ovariectomized Mice without Affecting Bone Formation. Mounier L, Morel A, Ferrandez Y, Morko J, Vääräniemi J, Gilardone M, Roche D, Cherfils J, Blangy A. J Med Chem. 2020 Nov 25;63(22):13680-13694. doi: 10.1021/acs.jmedchem.0c01201 Pubmed
- The osteoclast cytoskeleton – current understanding and therapeutic perspectives for osteoporosis. Anne Blangy, Guillaume Bompard, David Guerit, Pauline Marie, Justine Maurin, Anne Morel, Virginie Vives. Journal of Cell Science 2020 133: jcs244798 doi: 10.1242/jcs.244798 Published 1 July 2020 Pubmed
- Primary Myeloid Cell Proteomics and Transcriptomics: Importance of β-tubulin Isotypes for Osteoclast Function. Guérit D, Marie P, Morel A, Maurin J, Verollet C, Raynaud-Messina B, Urbach S, Blangy A. J Cell Sci. 2020 May 27;133(10):jcs239772. doi: 10.1242/jcs.239772. Pubmed
- The mechano-sensitive response of β1 integrin promotes SRC-positive late endosome recycling and activation of Yes-associated protein. Block MR, Brunner M, Ziegelmeyer T, Lallemand D, Pezet M, Chevalier G, Rondé P, Gauthier-Rouviere C, Wehrle-Haller B, Bouvard D. J Biol Chem. 295(39):13474-13487. Pubmed
- Flotillin membrane domains in cancer. Gauthier-Rouvière C, Bodin S, Comunale F, Planchon D. Cancer Metastasis Rev. 39(2):361-374. Pubmed
2019
- P-cadherin-induced decorin secretion is required for collagen fiber alignment and directional collective cell migration. Le Borgne-Rochet M, Angevin L, Bazellières E, Ordas L, Comunale F, Denisov EV, Tashireva LA, Perelmuter VM, Bièche I, Vacher S, Plutoni C, Seveno M, Bodin S, Gauthier-Rouvière C. J Cell Sci. 132(21):jcs233189 Pubmed
- Dock5 is a new regulator of microtubule dynamic instability in osteoclasts. Guimbal S, Morel A, Guérit D, Chardon M, Blangy A, Vives V. Biol Cell. 2019 Aug 28. doi: 10.1111/boc.201900014 Pubmed
- IFT88 controls NuMA enrichment at k-fibers minus-ends to facilitate their re-anchoring into mitotic spindles. Taulet N, Douanier A, Vitre B, Anguille C, Maurin J, Dromard Y, Georget V, Delaval B. Sci Rep. 9(1):10311. Pubmed
- The atypical RhoU/Wrch1 Rho GTPase controls cell proliferation and apoptosis in the gut epithelium. Slaymi C, Vignal E, Crès G, Roux P, Blangy A, Raynaud P, Fort P. Biol Cell. 2019 May;111(5):121-141 Pubmed
2018
- Methods to Investigate the Role of Rho GTPases in Osteoclast Function. Morel A, Blangy A, Vives V. Methods Mol Biol. 2018;1821:219-233. Pubmed
- Combined strategy of siRNA and osteoclast actin cytoskeleton automated imaging to identify novel regulators of bone resorption shows a non-mitotic function for anillin. Maurin J, Morel A, Hassen-Khodja C, Vives V, Jurdic P, Machuca-Gayet I, Blangy A. Eur J Cell Biol. 2018 Nov;97(8):568-579. Pubmed
- CSAP Acts as a Regulator of TTLL-Mediated Microtubule Glutamylation. Bompard G, van Dijk J, Cau J, Lannay Y, Marcellin G, Lawera A, van der Laan S, Rogowski K. Cell Rep. 25(10):2866-2877 Pubmed
- MT1-MMP targeting to endolysosomes is mediated by flotillin upregulation. Planchon D, Rios Morris E, Genest M, Comunale F, Vacher S, Bièche I, Denisov EV, Tashireva LA, Perelmuter VM, Linder S, Chavrier P, Bodin S, Gauthier-Rouvière C. J Cell Sci. pii: jcs.218925. Pubmed
2017
- Allosteric inhibition of the guanine nucleotide exchange factor DOCK5 by a small molecule. Ferrandez Y, Zhang W, Peurois F, Akendengué L, Blangy A, Zeghouf M, Cherfils J. Sci Rep. 7(1):14409. Pubmed
- The Evolutionary Landscape of Dbl-Like RhoGEF Families: Adapting Eukaryotic Cells to Environmental Signals. Fort P, Blangy A. Genome Biol Evol. 9:1471-1486. Pubmed
- Flotillins control zebrafish epiboly through their role in cadherin-mediated cell-cell adhesion. Morris EA, Bodin S, Delaval B, Comunale F, Georget V, Costa ML, Lutfalla G, Gauthier-Rouvière C. Biol Cell. Pubmed
- Tensins are versatile regulators of Rho GTPase signalling and cell adhesion. A. Blangy. Biol Cell. 109:115-126. Pubmed
2016
- Tensin 3 is a new partner of Dock5 that controls osteoclast podosome organization and activity. Touaitahuata H, Morel A, Urbach S, Mateos-Langerak J, de Rossi S, Blangy A. J Cell Sci., 129:3449-61. Pubmed
- The RhoE/ROCK/ARHGAP25 signaling pathway controls cell invasion by inhibition of Rac activity. Thuault S, Comunale F, Hasna J, Fortier M, Planchon D, Elarouci N, De Reynies A, Bodin S, Blangy A, Gauthier-Rouvière C. Mol Biol Cell. 27:2653-61. Pubmed
- P-cadherin promotes collective cell migration via a Cdc42-mediated increase in mechanical forces. Plutoni C, Bazellieres E, Le Borgne-Rochet M, Comunale F, Brugues A, Séveno M, Planchon D, Thuault S, Morin N, Bodin S, Trepat X, Gauthier-Rouvière C. J Cell Biol. 212:199-217. Pubmed
- P-cadherin-mediated Rho GTPase regulation during collective cell migration. Plutoni C, Bazellières E, Gauthier-Rouvière C. Small GTPases. 7:156-63. Pubmed
- Control of the Proliferation/Differentiation Balance in Skeletal Myoblasts by Integrin and Syndecan Targeting Peptides. Gribova V, Pignot-Paintrand I, Fourel L, Auzely-Velty R, Albigès-Rizo C, Gauthier-Rouvière C, Picart C. ACS Biomater. Sci. Eng., 2:415–425 Pubmed
- TOM1L1 drives membrane delivery of MT1-MMP to promote ERBB2-induced breast cancer cell invasion. Chevalier C, Collin G, Descamps S, Touaitahuata H, Simon V, Reymond N, Fernandez L, Milhiet PE, Georget V, Urbach S, Lasorsa L, Orsetti B, Boissière-Michot F, Lopez-Crapez E, Theillet C, Roche S, Benistant C. Nat Commun. 7:10765. Pubmed
2015
- Pharmacological inhibition of Dock5 prevents osteolysis by affecting osteoclast podosome organization while preserving bone formation. Vives V, Cres G, Richard C, Busson M, Ferrandez Y, Planson AG, Zeghouf M, Cherfils J, Malaval L, Blangy A. Nat Commun. 6:6218. Pubmed
- A novel therapeutic approach to fight osteoporosis: disrupt osteoclast activity without affecting bone formation. Blangy A. Med Sci (Paris) 31:584-6 Pubmed
2014
- The mineral dissolution function of osteoclasts is dispensable for hypertrophic cartilage degradation during long bone development and growth. Touaitahuata H, Cres G, de Rossi S, Vives V, Blangy A. Dev Biol. 393:57-70. Pubmed
- Modulation of osteoclast differentiation and bone resorption by Rho GTPases. Touaitahuata H, Blangy A, Vives V. Small GTPases. 5:e28119. Pubmed
- A receptor-interacting protein 1 (RIP1)-independent necrotic death under the control of protein phosphatase PP2A that involves the reorganization of actin cytoskeleton and the action of cofilin-1. Tomasella A, Blangy A, Brancolini C. J Biol Chem. 289:25699-25710. Pubmed
- Discoidin domain receptor 1 controls linear invadosome formation via a Cdc42-Tuba pathway. Juin A, Di Martino J, Leitinger B, Henriet E, Gary AS, Paysan L, Bomo J, Baffet G, Gauthier-Rouvière C, Rosenbaum J, Moreau V, Saltel F. J Cell Biol. 207:517-33. Pubmed
- Podosome organization drives osteoclast-mediated bone resorption. Georgess D, Machuca-Gayet I, Blangy A, Jurdic P. Cell Adh Migr. 8:191-204. Pubmed
- Dock-family exchange factors in cell migration and disease. Gadea G, Blangy A. Eur J Cell Biol. 93:466-77. Pubmed
- Promyelocytic leukemia zinc-finger induction signs mesenchymal stem cell commitment: identification of a key marker for stemness maintenance? Djouad F, Tejedor G, Toupet K, Maumus M, Bony C, Blangy A, Chuchana P, Jorgensen C, Noël D. Stem Cell Res Ther. 5:27. Pubmed
- Flotillins in intercellular adhesion – from cellular physiology to human diseases. Bodin S, Planchon D, Rios Morris E, Comunale F, Gauthier-Rouvière C. J Cell Sci. 127:5139-47. Pubmed
2013
- Flotillin microdomains stabilize cadherins at cell-cell junctions. Guillaume E, Comunale F, Do Khoa N, Planchon D, Bodin S, Gauthier-Rouvière C. J Cell Sci. 126(Pt 22):5293-304. Pubmed
- Effect of RGD functionalization and stiffness modulation of polyelectrolyte multilayer films on muscle cell differentiation. Gribova V, Gauthier-Rouvière C, Albigès-Rizo C, Auzely-Velty R, Picart C. Acta Biomater. 9(5):6468-80. Pubmed
- Rab35 regulates cadherin-mediated adherens junction formation and myoblast fusion. Charrasse S, Comunale F, De Rossi S, Echard A, Gauthier-Rouvière C. Mol Biol Cell. 2013 Feb;24(3):234-45. Pubmed
- P-cadherin is a direct PAX3-FOXO1A target involved in alveolar rhabdomyosarcoma aggressiveness. Thuault S, Hayashi S, Lagirand-Cantaloube J, Plutoni C, Comunale F, Delattre O, Relaix F, Gauthier-Rouvière C. Oncogene. 32(15):1876-87. Pubmed
- Targeting the Dbl and dock-family RhoGEFs: a yeast-based assay to identify cell-active inhibitors of Rho-controlled pathways. Blangy A, Fort P. Enzymes. 2013;33 Pt A:169-91. Pubmed
- Podosomes are dispensable for osteoclast differentiation and migration. Touaitahuata H, Planus E, Albiges-Rizo C, Blangy A, Pawlak G. Eur J Cell Biol. 92 :139-49. Pubmed
2012
- Cofilin activation during podosome belt formation in osteoclasts. Blangy A, Touaitahuata H, Cres G, Pawlak G. PLoS One. 2012;7(9):e45909. Pubmed
- Using a modified yeast two-hybrid system to screen for chemical GEF inhibitors. Blangy A, Fort P. Methods Mol Biol. 2012;928:81-95. Pubmed
2011
- The Rac1 exchange factor Dock5 is essential for bone resorption by osteoclasts. Vives V, Laurin M, Cres G, Larrousse P, Morichaud Z, Noel D, Côté JF, Blangy A. J Bone Miner Res. 2011 May;26(5):1099-110. Pubmed
2010
- Manipulation of the adhesive behaviour of skeletal muscle cells on soft and stiff polyelectrolyte multilayers. Ren K, Fourel L, Rouvière CG, Albiges-Rizo C, Picart C. Acta Biomater. 6(11):4238-48. Pubmed
- ADP-ribosylation factor 6 regulates mammalian myoblast fusion through phospholipase D1 and phosphatidylinositol 4,5-bisphosphate signaling pathways. Bach AS, Enjalbert S, Comunale F, Bodin S, Vitale N, Charrasse S, Gauthier-Rouvière C. Mol Biol Cell. 21(14):2412-24. Pubmed
2009
- N-cadherin/p120 catenin association at cell-cell contacts occurs in cholesterol-rich membrane domains and is required for RhoA activation and myogenesis. Taulet N, Comunale F, Favard C, Charrasse S, Bodin S, Gauthier-Rouvière C. J Biol Chem. 2009 Aug 21;284(34):23137-45. Pubmed
- A 20-amino acid module of protein kinase C{epsilon} involved in translocation and selective targeting at cell-cell contacts. Diouf B, Collazos A, Labesse G, Macari F, Choquet A, Clair P, Gauthier-Rouvière C, Guérineau NC, Jay P, Hollande F, Joubert D. J Biol Chem. 284(28):18808-15. Pubmed
- RhoA leads to up-regulation and relocalization of utrophin in muscle fibers. Gauthier-Rouvière C, Bonet-Kerrache A. Biochem Biophys Res Commun. 384(3):322-8. Pubmed
2008
- R-Cadherin expression inhibits myogenesis and induces myoblast transformation via Rac1 GTPase. Kucharczak J, Charrasse S, Comunale F, Zappulla J, Robert B, Teulon-Navarro I, Pèlegrin A, Gauthier-Rouvière C. Cancer Res. 68(16):6559-68. Pubmed
- RhoE controls myoblast alignment prior fusion through RhoA and ROCK. Fortier M, Comunale F, Kucharczak J, Blangy A, Charrasse S, Gauthier-Rouvière C. Cell Death Differ. 15(8):1221-31. Pubmed
Cytoskeleton and membrane trafficking dynamics in cellular adhesion

 Anne BLANGY & Cécile GAUTHIER-ROUVIÈRE
Anne BLANGY & Cécile GAUTHIER-ROUVIÈRE
Group leaders (Research Directors CNRS and INSERM)
Team Members
(AI-Recherche) +33 (0)4 34 35 95 11 |
|
(Chercheur DR1) +33 (0)4 34 35 95 11 |
|
(Maître de conférences) +33 (0)4 34 35 95 11 |
|
(Chercheur DR1) +33 (0)4 34 35 95 08 |
|
(Chercheur) +33 (0)4 34 35 95 07 |
|
(Doctorant) +33 (0)4 34 35 95 10 |
|
(Doctorant) +33 (0)4 34 35 95 07 |
|
(Stagiaire) +33 (0)4 34 35 95 07 |
Contact us
Replace the name and address above with that of the member to contact
firstname.name@crbm.cnrs.fr
GRANTS